El movimiento browniano
El movimiento browniano es uno de aquellos temas olvidados, que apenas aparece en los libros de texto; pero que fue la primera prueba concluyente de la hipótesis atómica y que, además, hizo que cambiáramos el modo en que entendemos hacer ciencia. Quisiera hablaros hoy de este fenómeno que empieza en la persona de Robert Brown.
Robert Brown fue hijo de un pastor protestante escocés. Nacido en 1773 fue el típico erudito autodidacta, soberbio, diligente y meticuloso hasta el fanatismo. Estudió medicina en Edimburgo y trabajó unos años como ayudante de un cirujano en un regimiento de Fifeshire.
Mientras hacía esto, se puso a aprender alemán. Estudiaba los nombres y sus declinaciones antes del desayuno y la conjugación de los verbos auxiliares después. Armado con sus nuevos conocimientos, empezó a dominar toda la documentación alemana sobre botánica.
En 1798 hizo una visita a Londres donde conoció al gran botánico Sir Joseph Banks, en aquel momento presidente de la Royal Society. Nuestro hombre lo impresionó de tal manera que tres años después hizo, con la recomendación del mismo Banks, un largo viaje a Australia regresando en 1805 con cerca de 4.000 especímenes de plantas exóticas pulcramente guardadas en el barco.
Pasó varios años describiendo, clasificando y catalogando esos especímenes, a la vez que trabajaba de bibliotecario y asistente personal de Banks. De ahí, salió el embrión de lo que ha llegado a ser el departamento botánico del Museo Británico, del que fue el primer encargado profesional.
Brown conoció a Charles Darwin. Darwin dijo de él que era contradictorio, profundamente sabio, pero muy dado a la pedantería, generoso en unos aspectos, malhumorado y receloso en otros. Me pareció que destacaba sobre todo por la puntillosidad de sus observaciones y su perfecta exactitud. Darwin dijo también de él que nunca prestaba especímenes de su colección, incluso ni aquellos que él y sólo él poseía y que nunca le iban a ser de utilidad.
 Brown es conocido, sobre todo, por un estudio de los granos de polen de la Clarkia pulcella, una flor silvestre popular actualmente entre los jardineros, descubierta en 1806 por Meriwther Lewis, aunque le puso el nombre de su compañero de exploración: William Clark (actualización: leer comentario). Brown pretendía analizar minuciosamente la forma y tamaño de los granos de polen con un microscopio. Pero se encontró con un problema: no paraban de moverse. Se desplazaban erráticamente por el campo de visión. No era el primero que veía eso. Ya Leeuwenhoeck (¿recordáis a a nuestro amigo el bedel?) había escrito que los "animáculos" se movían en el agua cuando los observaba arriba, abajo, en círculo… decía que era fantástico observarlo. Algunos de aquellos animáculos tenían minúsculas pilosidades o finísimas extensiones que les permitían nadar, así que el movimiento podía ser explicado por la fuerza vital.
Brown es conocido, sobre todo, por un estudio de los granos de polen de la Clarkia pulcella, una flor silvestre popular actualmente entre los jardineros, descubierta en 1806 por Meriwther Lewis, aunque le puso el nombre de su compañero de exploración: William Clark (actualización: leer comentario). Brown pretendía analizar minuciosamente la forma y tamaño de los granos de polen con un microscopio. Pero se encontró con un problema: no paraban de moverse. Se desplazaban erráticamente por el campo de visión. No era el primero que veía eso. Ya Leeuwenhoeck (¿recordáis a a nuestro amigo el bedel?) había escrito que los "animáculos" se movían en el agua cuando los observaba arriba, abajo, en círculo… decía que era fantástico observarlo. Algunos de aquellos animáculos tenían minúsculas pilosidades o finísimas extensiones que les permitían nadar, así que el movimiento podía ser explicado por la fuerza vital.
Aunque los granos de polen eran simples y carecían de partes móviles eran innegablemente orgánicos. Brown supuso que, al ser las partes masculinas del equipo reproductivo de una planta, también tenían ese espíritu vital que los impulsaba a moverse. No obstante, desconfiaba de estas hipótesis tan vagas. A Brown le encantaba la observación, así que observó otras plantas y pudo ver también un movimiento similar, pero lo mismo sucedió con fragmentos de hojas y tallos.
Probó con partículas de colorante, pequeños fragmentos de un trozos de madera petrificada, trozos de cristal ordinario, etc. Incluso con polvo de un trozo de la Esfinge a la que tenía acceso como encargado del Museo Británico. Aunque era materia indudablemente inanimada o muerta bailoteó como todo lo demás.
Intentó averiguar la causa de esos movimientos. Aparte de no ser debidos al movimiento vital, tampoco lo eran por vibración, por acción del calor o por influencias eléctricas o magnéticas. Todo era contradictorio e incomprensible: las partículas no podían moverse por voluntad propia si no había alguna influencia externa. Pero se movían. Como era un escrupuloso botánico descriptivo y no un filósofo de la naturaleza no hizo hipótesis alguna. Murió en 1858 y, como dijo Charles Darwin: con él murieron muchas cosas, debido a un excesivo temor de no cometer nunca un error.
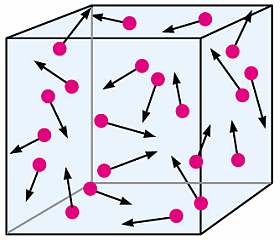
La comunidad científica ignoró el movimiento browniano durante décadas. Los que lo observaban lo consideraban una molestia y la mayoría de los botánicos y zoólogos persistían en la idea del movimiento vital. No obstante, la cosa iba a cambiar. Ludwig Christian Wiener era un profesor que daba clases de matemáticas y geometría en universidades alemanas. En 1863 repitió los experimentos de Robert Brown e hizo una hipótesis muy especulativa: que todo ese movimiento era explicable si el líquido en el que se retorcían las partículas brownianas estaban compuestos de furiosos átomos que las chocaban por todas partes.
Pensad que por aquella época los átomos eran demasiado pequeños para ser vistos ni percibidos por ningún medio directo, y aunque podían resultar muy útiles como modelos no se acababa de aceptar su existencia. Naturalmente los químicos se veían casi forzados a creer en ellos. Si no existieran, ¿cómo podrían explicar tantas reacciones químicas con tanta sencillez? ¿Por qué habría de comportarse la materia, en tantos sentidos y tan enteramente como si fuera atómica, no siéndolo en realidad? Algunos químicos, sin embargo, sostenían que no era prudente salirse de los fenómenos mensurables. Así pensaban hombres como Wilhelm Ostwald, quienes exigían de forma rigurosa efectos directamente observables para aceptar su existencia. Incluso a principios del siglo XX mantenía que los átomos no existían.
Allá por los años 1860, el físico escocés James Clerk Maxwell había propuesto una impresionante explicación de las propiedades de los gases a base de partículas moviéndose al azar. Maxwell había aprendido toda esa estadística leyendo al matemático belga Adolphe Quetelet, quien había clasificado los índices de criminalidad en Francia de acuerdo con la edad, educación, clima de la localidad en la que se sufría el crimen y la época del año en que se producía; lo que había sido el principio de la aplicación de los métodos estadísticos a las ciencias demográficas y sociales.
En seguida surgió la sospecha de que las partículas del líquido, al moverse al azar, podrían empujar en uno y otro sentido a las partículas más gruesas en suspensión. Podía ser que los granos de polen o de tinte estuvieran siendo bombardeados por las partículas de agua y que fuera eso era lo que producía el movimiento browniano. Podría haber momentos en que les chocarían más partículas de un lado que de otro y de este modo nosotros veríamos a la partícula browniana desplazándose aun sin ver a las pequeñas. En suma, estaban viendo el resultado de la acción directa de los átomos que componían la suspensión.
Una serie de jesuitas franceses también formuló esa misma hipótesis. El Padre Joseph Delsaulx atribuye a un colega anónimo la idea de que el movimiento browniano era el resultado de la agitación constante de las partículas o átomos que componen un líquido. El problema es que había que demostrarlo pero no tenían el aparato matemático necesario. Aunque Botzmann sí lo tenía no intentó resolverlo. Ni siquiera Maxwell se interesó.
Vamos al año 1905 cuando entra en escena un hombre de 26 años. Trabajaba en una casa de patentes en Berna porque había sido incapaz de conseguir una posición académica. Aparte de realizar su trabajo, cuando no había jefes por allá, desarrollaba sus ideas de física. Tenía que hacerlo con cuidado, pues cuando el jefe entraba tenía que esconder rápidamente esos bocetos y fórmulas en un cajón. El nombre de este hombre no es otro que Albert Einstein.
El gran sabio llegó a sentirse fascinado por las densas y prolijas monografías de Boltzmann. También él se dio cuenta que una partícula lo bastante pequeña sumergida en un líquido rebotaría por todas partes a causa de las colisiones moleculares. Se preguntó si el movimiento de una partícula suficientemente grande como para ser vista al microscopio podría constituir una prueba directa de la existencia de los átomos.
No era tarea fácil. Otros científicos anteriores habían visto que una partícula browniana tenía que tener, por término medio, la misma energía de movimiento que las moléculas del líquido en las que estaban suspendidas. Esas moléculas de líquido con masa mucho menor se moverían por todas partes a toda velocidad, mientras que las partículas brownianas avanzaban de forma mucho más torpe. Por supuesto, había que aplicar estadística. Resumiendo, había que encontrar una relación matemática entre la velocidad media de una molécula de líquido (que se movía muy deprisa) y la velocidad media de la molécula browniana (que se movía más despacio). Recordemos, además, que el movimiento browniano es mayormente errático.
Einstein siguió otro camino, como tantas veces hizo. Trazó un círculo imaginario alrededor de una molécula y se preguntó cuánto tardaría, por término medio, en alcanzar el borde de dicho círculo. De este modo, obtuvo un resultado teórico que podía ser sometido a experimentación. Estos resultados fueron publicados en 1905 junto a otros famosos ensayos, entre ellos la Teoría Especial de la Relatividad y otras provocadoras ideas sobre la naturaleza corpuscular de la luz.
Aquí hay un detalle sorprendente. Resulta que cuando Einstein inició sus cálculos, ni siquiera había oído hablar del movimiento browniano. Fue mientras lo escribía cuando se enteró que el fenómeno ya era conocido por botánicos y otros durante generaciones anteriores. De hecho, en la introducción escribió:
Es posible que los movimientos que se discutirán aquí sean idénticos al llamado "movimiento molecular browniano"; sin embargo, los detalles que he conseguido establecer en relación a este último son tan imprecisos que no puedo formarme un juicio sobre el particular.
Según su fórmula, las partículas suspendidas en un vaso alto de líquido debían reflejar, en su distribución, el equilibrio entre la fuerza gravitatoria y el efecto del movimiento browniano. Si actuase sólo la gravedad, todas las partículas se irían al fondo. Si sólo actuase el movimiento browniano, se esparcirían con uniformidad. Bajo la acción de ambos fenómenos deberían esparcirse concentrándose hacia el fondo cada vez con más densidad.
Einstein era un teórico y se conformó con obtener la ecuación. Tres años después, en 1908, el físico francés Jean Perrin suspendió en agua granitos de resina y de goma y contó el número de granos a distintos niveles. Halló que ese número crecía hacia abajo. Y lo mejor de todo: concordaba exactamente con lo predicho por la ecuación de Einstein.
También obtuvo, además, una medida razonablemente aproximada del peso real de las moléculas sueltas. El antiatomista Ostwald se enfrentó entonces con un experimento observable, producido por moléculas individuales. No pudo seguir negando la existencia de los átomos.
Perrin recibió por su trabajo el premio Nobel de Física en 1926. Einstein había recibido el suyo en 1921, por otros méritos (merecía otro Nobel, ¿verdad?; y si tenemos en cuenta que no por la relatividad… En fin. Continuemos).
Pero algo más había cambiado. Por primera vez un razonamiento estadístico permitía a los físicos hablar sobre el comportamiento de multitudes de átomos sin conocer el comportamiento de cada uno por separado. Incluso aunque su observación estuviera más allá de sus posibilidades. O sea, que podíamos conocer el edificio sin saber cómo eran los ladrillos.
Más aún. Hasta entonces, la teoría y el experimento habían ido de la mano. Ahora eso ya dejaba de suceder. La teoría contenía elementos sobre cuya existencia real los físicos no tenían duda alguna, pero no podían llegar de forma experimental. Mientras que para el teórico los átomos tenían una existencia evidente y una posición y velocidad determinadas (la cuántica todavía no había entrado en juego), para el experimental los átomos sólo existían de forma deducible y únicamente podían ser descritos estadísticamente.
Un gran cambio, ¿verdad?
Para acabar, quiero recordaros qué contestó Feynman cuando le preguntaron que si se acabara el mundo y desapareciera todo el conocimiento, qué idea científica guardaría. Dijo: "que la materia se compone de átomos".
Artículo original de historiasdelaciencia.com amparado con Licencia Creative Commons Reconocimiento 2.5.
Fuente: omalaled – historiasdelaciencia.com