El espectro de la radiación
Desde el siglo XVII sabemos, con los trabajos de Newton y Huygens, que la radiación luminosa, la luz, se desvía al atravesar un medio de densidad distinta, como el agua. Sufre una dispersión.
Resulta que sus componentes se desvían con diferente ángulo, por lo que al salir del medio que atraviesan, salen las componentes separadas por distintos ángulos y se pueden identificar visualmente por los diferentes colores que muestran.
Así, cuando la luz blanca que procede del sol atraviesa gotas de lluvia, esta se desvía, y sus componentes, que son las de luz de color rojo, naranja, amarillo, verde, azul, añil y violeta, se separan formando el arco iris. Esto ocurre debido a que las componentes de la luz blanca del Sol, en desplazamiento general de 300000 kms por segundo, tienen diferentes longitudes de onda.
La luz blanca procedente de nuestra estrella, el Sol, es la principal radiación que recibimos en nuestro planeta. ¿Cómo estudiar la radiación?
01. El espectro de la radiación.
02. Espectros de emisión y espectros de absorción.
03. La espectroscopia. Aparatos de medición.
01. El espectro de la radiación:
En determinadas condiciones, los cuerpos emiten energía en forma de radiación. También los cuerpos absorben la radiación que emiten otros cuerpos, asimilando energía.
¿Cómo medir la radiación emitida o la radiación absorbida por los cuerpos?. Un aparato capaz de obtener el espectro de una radiación, es decir, de separar la radiación en sus componentes, se llama un espectroscopio. Si el aparato es capaz de fotografiarla se llama un espectrógrafo, y si es capaz de medirla diremos que se trata de un espectrómetro. Cuando es capaz de medir también la intensidad de la radiación, se llama espectrofotómetro.
La principal emisión de radiación de los cuerpos es la radiación electromagnética en forma de luz visible.
Se dice que el arco iris es el espectro de la luz visible procedente del sol. En el ejemplo del espectro constituido por el arco iris, son las gotas de lluvia y el aire atmosférico lo que hacen de espectroscopio.
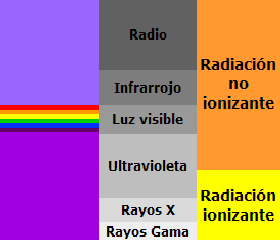
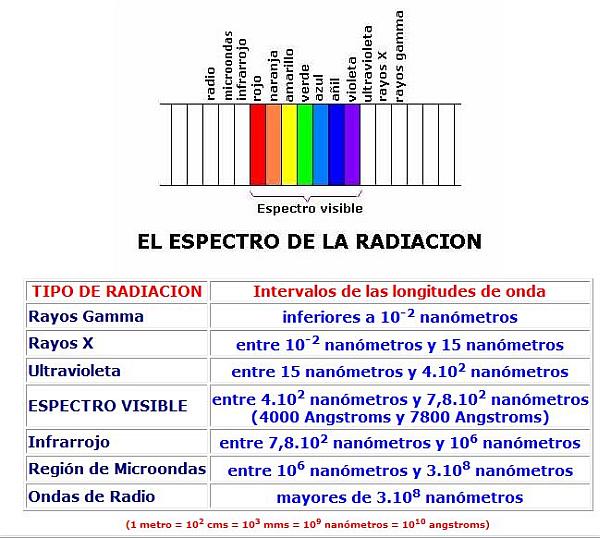
La longitud de onda de la radiación puede ser desde muy pequeña, en el caso de la llamada radiación gamma, hasta muy grande en las ondas de radio. Se mide, pues, usando desde nanómetros y ángstroms hasta cientos de metros. Recordemos que un nanómetro es la milmillonésima parte de un metro (1 m = 109 nms) y que un Ángstrom es la diez mil millonésima parte de un metro (1 m = 1010 A), por lo que un nanómetro equivale a 10 Ángstrom (1nm = 10 A)
La luz que recibimos del Sol es radiación electromagnética que se desplaza a 300.000 kms/s, en su totalidad, pero la longitud de onda no es la misma en todos los fotones luminosos, sino que varía entre los 4000 A y los 7000 A, aproximadamente, o lo que es lo mismo, entre los 400 nm y los 700 nm. La luz blanca se descompone, en definitiva, en un espectro de diferentes bandas coloreadas, cada una definida por una longitud de onda distinta. Así, la luz de menor longitud de onda es la luz violeta, que es de alrededor de unos 4000 Ángstroms, y la luz de mayor longitud de onda es la luz roja, que es de alrededor de unos 7000 Ámgstroms.
Sin embargo, hay radiaciones de mayor y también de menor longitud de onda, es decir, que tienen una longitud de onda inferior a 4000 Angstroms y que tienen una longitud de onda superior a los 7000 Angstroms.
Las radiaciones que van desde el violeta al rojo se dice que forman el espectro visible, pues procede de la descomposición de la luz blanca.
Las radiaciones de longitud de onda inferior al violeta se llaman radiación ultravioleta, rayos X, y rayos gamma, por orden decreciente en la longitud de onda.
Las radiaciones de longitud de onda superior al rojo son las denominadas infrarrojo, microondas y ondas de radio, por orden creciente en longitud de onda.
02. Espectros de emisión y espectros de absorción:
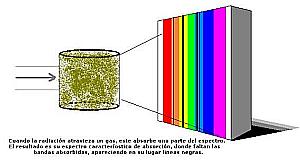
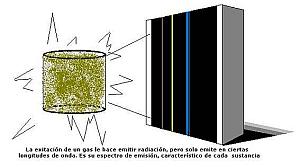
Cuando un elemento irradia energía no lo hace en todas las longitudes de onda. Solamente en aquellas de las que está "provisto". Esas longitudes de onda sirven para caracterizar, por tanto, a cada elemento. También ocurre que cuando un elemento recibe energía no absorbe todas las longitudes de onda, sino solo aquellas de las que es capaz de "proveerse". Coinciden por tanto, las bandas del espectro en las que emite radiación con los huecos o líneas negras del espectro de absorción de la radiación, como si un espectro fuera el negativo del otro.
|
|
|
|
|
|
Se acostumbra a llamar "cuerpo negro" al cuerpo ideal que absorbe todas las longitudes de onda y, por consiguiente, emite radiación también a todas las longitudes de onda. Sería, en definitiva, un emisor perfecto de radiación. A cada temperatura emitiría una cantidad definida de energía por cada longitud de onda.
El fracaso en el intento de explicar la radiación del cuerpo negro desde los conceptos de la física condujo al descubrimiento de Planck de que la emisión de energía es un múltiplo de la frecuencia de a radiación: E = h. u
02.1. Los espectros de emisión:
Todos los cuerpos emiten energía a ciertas temperaturas. El espectro de la radiación energética emitida es su espectro de emisión. Todos los cuerpos no tienen el mismo espectro de emisión. Esto es, hay cuerpos que emiten en el infrarrojo, por ejemplo, y otros cuerpos no.
En realidad, cada uno de los elementos químicos tiene su propio espectro de emisión. Y esto sirve para identificarlo y conocer de su existencia en objetos lejanos, inaccesibles para nosotros, como son las estrellas.
Así, el sodio tiene su característico espectro de emisión, lo mismo que el calcio, o que el hidrógeno, etc..
Algunos ejemplos de espectros de emisión:
 |
 |
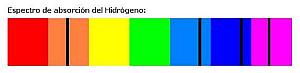
| Diremos que el hidrógeno emite, dentro del visible, en una cierta longitud de onda del naranja (6560 A), en otra del azul (4858 A), otra del añil (4337 A) y otra del violeta (4098 A). |
El sodio (Na) emite en el amarillo (bandas de longitudes de onda de 5896 A y 5890 A). |
|
|
|
| El gas noble Neón (Ne) emite en el espectro visible en las longitudes de onda de 6402 A (naranja), 5852 A (amarillo) y 5400 A (verde). |
El Calcio emite en la longitud de onda del espectro visible 6162 A (amarillo-naranja), 4454 A y 4435 (color añil) y 4226 A (violeta). |
02.2. Los espectros de absorción:
Y también los cuerpos absorben radiación emitida desde otros cuerpos, eliminando del espectro de radiación que reciben aquellas bandas absorbidas, que quedan de color negro. Son lo que se llaman "rayas negras" o simplemente "rayas" del espectro.
También ocurre con la absorción, que unos cuerpos absorben la radiación de unas determinadas longitudes de onda y no absorben la radiación de otras longitudes de onda, por lo que cada cuerpo, cada elemento químico en realidad, tiene su propio espectro de absorción, correspondiéndose con su espectro de emisión, cual si fuera el negativo con el positivo de una película.
Algunos ejemplos de espectros de absorción:
 |
 |
| El hidrógeno, pues, absorbe radiación en las mismas bandas en las que la emite, es decir, absorbe en una cierta longitud de onda del naranja, en otra longitud de onda del azul, en otra del añil y en otra del violeta. |
También, por consiguiente, el sodio (Na) absorbe en las mismas bandas de longitud de onda en las que emite. |
|
|
|
| El gas Neón absorbe, naturalmente, las mismas bandas que figuran en su espectro de emisión. |
El calcio (Ca) absorbe también las líneas que figuran en su espectro de emisión. |
02.3. El Espectro Solar:
 |
|
Se observa fácilmente, por tanto, la existencia de Sodio (las dos líneas amarillas), hidrógeno, etc. |
Si analizamos mediante un espectroscopio la luz que nos llega del Sol observamos en el espectro que no es completamente continuo, sino que aparecen ciertas rayas de absorción. Indicándonos este hecho que la luz del sol ha atravesado gases que han absorbido las longitudes de onda que a cada uno de ellos le es característica. Algunos de estos elementos sabemos que no pueden existir en la atmósfera de nuestro planeta, por lo que hemos de concluir que se encuentran en la atmósfera solar.
El primero en describir las líneas oscuras del espectro solar fué Joseph Von Fraunhofer (1787-1826), por lo que se le denominaron "Líneas de Fraunhofer", aunque ya habian sido descubiertas en 1802 por William H. Wollaston (1766-1828).
03. Espectroscopia. Aparatos de medición:
La Espectroscopia es el estudio de los espectros de los cuerpos físicos. Se fundamenta en el hecho de que cada elemento químico tiene su propio espectro de emisión y de absorción.
Para el estudio de los espectros de los elementos químicos se usan aparatos diversos, fundamentalmente son:
– El espectroscopio: que al descomponer la luz incidente dispersándola en diferente radiaciones monocromáticas, permite la observación directa del espectro de un determinado elemento.
– El espectrógrafo, que permite fotografiar las bandas de emisión y absorción de los elementos.
– El espectrómetro, cuyo objeto es la medición de las longitudes de onda de emisión y absorción en los espectros.
Todos son aplicables a la Espectroscopia astronómica.
03.1. Espectroscopios:
Son aparatos que dispersan la radiación incidente, lo cual se puede realizar por refracción en los llamados espectroscopios de prisma o bien por difracción, en los espectroscopios de red.
El espectroscopio de prisma fue desarrollado a partir de 1859 por los alemanes Kirchoff y Bunsen.
|
|
|
|
Espectroscopio ECYT 12-810 (tecnoedu.com) |
Este modelo es una antigüedad que data de la segunda mitad del siglo XIX (xtec.es) |
En el espectroscopio de red se consigue dispersar la radiación mediante una superficie reflectante sobre la cual se han trazado miles de surcos paralelos muy finos. Un CD ROM , y debido a sus líneas, es un ejemplo elemental de espectroscopio de red.
Se pueden encontrar fácilmente espectroscopios comercializados en la red destinados a los centros educativos. El modelo de la siguiente figura se puede encontrar en la dirección de Internet:
03.2. Espectrógrafos:
Son instrumentos que registran fotográficamente, o por medio de detectores fotosensibles, las diferentes componentes del espectro. Su estructura es similar a la del espectroscopio, sustituyendo el ocular por una placa fotográfica o un detector.
Las siguientes imágenes corresponden a tipos diferentes de espectrógrafos:
|
|
|
|
03.3. Espectrómetros:
Se ha desarrollado comercialmente una gran variedad de tipos de espectrómetros, prácticamente, existe un espectrómetro especializado en cada tipo de medición.
Podemos encontrar fácilmente en la red la características de muchos tipos de espectrómetros:
- Espectrómetro de rayos gamma, con diferentes tipos utilizados en Astrofísica para detectar esta forma de radiación.
- Espectrómetros de emisión óptica.
- Espectrómetro de masas.
- Espectrómetro de masas de alta resolución.
- Espectrómetro de masas de baja resolución.
- Especializados en radiación térmica infrarroja.
También se pueden encontrar en la red Applets que permiten simular pruebas de experimentación del espectrógrafo de masas, con carácter educativo.
Espectrómetro de neutrones, utilizado en trabajos de investigación lunar.
Espectrofotómetro: Se basan en la absorción, emisión o fluorescencia por átomos o iones elementales
|
|
|
Espectrofotómetro (Imagen tomada de jenck.com) |
Espectrofotómetro:
Se utilizan bastante los llamados espectrómetros de esfera, que permiten realizar mediciones de color sobre cualquier tipo de superficie (plásticos, liquidos, etc.) ya que miden la luz que se difunde dentro de una esfera contenida en el aparato.
Carlos S. Chinea (casanchi AT teleline.es).
Fuente: Carlos S. Chinea – casanchi.com